Doğadaki sayının fazlalığına rağmen,organizmadaki proteinlerin yapısına katılan sadece 20 aminoasit bulunmaktadır.
Çeşitli insan proteinlerinin hepsinin primer yapıları genetik kod tarafından belirlenmiş lineer bir sırayla 20 aminoasitten sentezlenerek düzenlenir.Bunlar,DNA tarafından kodlanabilen aminoasitlerdir.
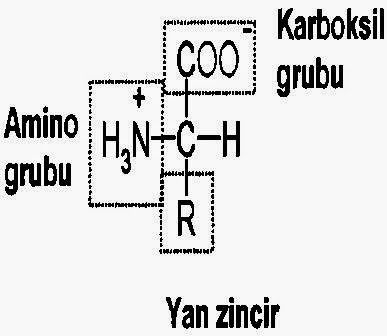
Proteinlerde bulunan 20 standart aminoasitin hepsi de a-amino asittir.
Bu isimlendirmenin nedeni,aminoasitlerde amino grubunun a -karbon atomuna bağlanmış olmasıdır. a -karbon atomu,karboksil grubundan sonraki ilk karbon atomuna verilen addır.
Aminoasitlerin genel yapısı
Protein sentezinde kullanılan aminoasitlerin her biri aynı genel yapıya sahiptir.Bunlar,bir karboksilik asit grubu,amino grubu,hidrojen atomu ve R grubu olarak adlandırılan ve her amino asit için farklı olan grup.
4 farklı grupla bağ yapan bu karbon atomu asimetrik karbon atomu olarak adlandırılır. Asimetrik karbonlar kiral merkezler olarak adlandırılır.
Glisin dışındaki tüm aminoasitlerde a -karbon atomu 4 farklı grupla bağ yapar,glisinde R grubu bir diğer hidrojen atomudur.
Asimetrik karbon atomuna sahip aminoasitler optikçe aktiftir,yani düzlemsel polarize ışığı çevirirler.Dört farklı grubun -karbon atomu çevresinde tetrahedral konuşlanışı amino asitlere optik etkinlik kazandırmaktadır.
Polarize ışığı sağa veya sola çevirmelerine göre aminoasitler L(levorotator) ve D(dextrorotator) olarak sınıflandırılmalarına rağmen,3 karbonlu şeker olan gliseraldehit örnek alınarak yapılan D L sisteminde,L-gliseraldehitle konfigürasyon benzerliği olanlar L-amino asit olarak adlandırılmıştır.
Bu nedenle,proteinlerde bulunan amino asitelerin bazıları polarize ışığı sağa veya sola çevirmelerine karşın hepsi L-gliseraldehitin mutlak konuşuna sahiptir,yani L- a -aminoaistlerdir.
D-aminoasit kalıntıları ise,bazı peptit antibiyotiklerde,bakteri hücre duvarında bulunabilir.
RS Sistemi
Birden fazla kiral merkez içeren bileşikler için RS sistemi terminolojisi daha yararlıdır.
Kiral atomu en düşük önceliğe sahip grup,en uzak noktada kalacak şekilde gözlemlenir.Eğer diğer 3 grubun önceliği saat yönü dizilişinde azalıyorsa,konfigürasyon R(rectus,sağ), saat yönünün tersine bir diziliş varsa konfigürasyon S(sinister,sol) olarak adlandırılır.
Bu sistemlerin amacı,asimetrik karbon atomunun 4 bağlantısının mutlak(bağıl) şekli için özel bir bilimsel sınıflandırma yapılmasıdır.
Bir tetrahedral karbon atomuna bağlı 4 farklı yer değiştiren grup uzayda,benzer veya aynı kimyasal özellikleri olan,ancak belirli fizyolojik ve biyolojik özellikleri farklılaşan iki stereoizomere yol açarak iki farklı şekilde düzenlenebilir.
Bir karbon atomu 4 farklı yer değiştiren gruba sahipse,ayna görüntüsü birbiri ile çakışmayan iki formda düzenlenebilir.Buna enantiyomer denir.
Birbirinin ayna görüntüsü olmayan stereoizomer çiftleri diyastomer olarak adlandırılır
Proteinlerde bu amino asitler,bir amino asitin karboksilik asit grubuyla sonraki aminoasitin amino grubu arasında oluşan peptit bağlarıyla,polipeptit zincirleri denen lineer polimerler oluşturmak üzere birleşir.
Amino asitlerin sınıflandırılması
Amino asitlerde bulunan R değişken grubunun kimyasal özellikleri bağ tiplerini ve bir polipeptit zincirindeki her bir amino asitin diğer moleküllerle olabilecek etkileşimlerini belirler.
Proteinlerdeki amino asitler,a-karbon atomlarına bağlı R gruplarının polar olup olmadığı temeline göre iki geniş gruba ayrılabilir.
* Polar(hidrofilik aminoasitler):
-su ile hidrojen bağları oluşturabilirler.
-bu nedenle proteinlerin su ile temas eden dış yüzünde bulunma eğilimindedirler.
* Nonpolar(hidrofobik)aminoasitler ise;
Su ile hidrojen bağı oluşturamazlar, proteinlerin iç yüzünde bulunurlar.
R gruplarının pozitif veya negatif yüklü olmasına göre,aminoasitler asidik veya bazik olarak da sınıflandırılırlar.Buna göre;
İkinci bir amino grubu taşıyan lizin,pozitif yüklü guanidin grubu taşıyan arjinin ve imidazol grubu taşıyan histidin pH:7’de pozitif yüklü R-grubu taşıyan aminoasitlerdir.
Buna karşılık,ikinci bir karboksil grubuna sahip aspartat ve glutamat,pH:7’de negatif net yüke sahiptir yani asidik aminoasitlerdir.
Alifatik amino asitler
Alifatik amino asitler,yan zincirlerinde(R) heteroatom(O,N,S) taşımayan ve halka yapısı göstermeyen aminoasitlerdir??
Bunlar:glisin,alanin,valine,lösin ve isolösindir.
Aromatik Amino Asitler
Aromatik halka,üç konjuge çift bağlı altı üyeli karbon-hidrojen halkasıdır.
Aromatik halkaya sahip amino asitler;
*Fenilalanin(benzen halkası),
*Tirozin(fenol grubu),
*Triptofan(indol halkası),
*Histidin(imidazol grubu).
Aromatik amino asitlerin ortak özelliği,
240-270nm dalga boyundaki UV ışığı absorbe etmeleridir.
Triptofan,en kuvvetli absorblama kapasitesine sahiptir.
Hidroksil grubu içeren aminoasitler
Serin
Treonin
Tirozin
*Her hangi bir bileşik hidroksil grubu içeriyorsa,o bileşik polardır.Bunlar su ile hidrojen bağı oluşturabildikleri için proteinlerin suyla temas eden dış yüzünde bulunma eğilimindedirler.
Sülfür içeren amino asitler
>Sistein:
-sülfidril grubu içerir.Disülfid bağı oluşturur
>Metionin:
-metil grubu içerir.Esansiyel a.a.’tir.
Aminoasitler,amfoterik özelliğe sahiptir, bir başka deyişle çözeltinin H iyon konsantrasyonuna göre asit ya da baz olarak fonksiyon görürler.Bu nitelikleri karbonil gruplarının proton verebilme, buna karşın amino gruplarının proton alabilme yeteneğinden kazanılır.
Her amino asit,kendilerine özgü bir pH noktasında eşit sayıda negatif ve pozitif yüke sahiptir.Amino asitlerin yüksüz formda bulundukları bu pH değerine izoelektrik nokta adı verilir.
pKa değeri,asitlerin ayrışma sabitinin negatif logaritmasıdır.pKa değeri düşük asitler,kuvvetli asitlerdir.
Histidin,sahip olduğu imidazol protonuna ait pK’nın kendisine pH:7’de baz veya asit gibi davranabilme yetisi vermektedir.
Bu nedenle fizyolojik pH’da histidin en güçlü tampon görevi gören aminoasittir.
Hemoglobinin yapısında bulunması bu açıdan önem taşımaktadır.
Asidik ve bazik niteliklerinin yaklaşık olarak eşit olması nedeniyle,nötral aminoasitler sulu çözeltilerinde nötral reaksiyon verirler.Örnek olarak glisinin değişik pH değerli çözeltilerdeki titrasyon eğrisi görülmektedir.
Titrasyon eğrisinin değerlendirilmesinden asidik ve bazik grupların dissosiasyon sabitleri(pK) ve izoelektrik noktaları ortaya konulabilir.
Standart dışı aminoasitler
Bilinen 20 aminoasidin dışında, protein yapısına katılan ve bilinen aminoasitlerin modifikasyonuyla oluşan aminoasitler de vardır.
Bunlardan bazıları;
*4-hidroksiprolin ve 5-hidroksilizin: kollajenin yapısında bulunurlar.
*6-N-metillizin:kasın kontraktil proteini olan miyozinin bileşenidir.
Bir diğer önemli standart dışı aminoasit,
γ-karboksiglutamat’tır.Bu aminoasit kan pıhtılaşma proteini olan protrombinin yapısında ve biyolojik fonksiyon olarak Ca bağlayan proteinlerin yapısında bulunur.
Aminoasitlerin varlığının saptanması ve ayrıştırılması
Ninhidrin reaksiyonu amino asitlerin saptanmasında duyarlılığı ve spesifitesi nedeniyle büyük pratik öneme sahiptir.
Amino asit ninhidrin ile reaksiyona girerse aminoasit 1 C atomu eksik aldehide oksitlenirken,1 mol CO2 ve NH3 serbest kalır.Daha sonra 1 mol ninhidrin,1 mol redükte ninhidrin ve NH3 tekrar reaksiyona girer,mavi menekşe renk oluşur.
Bu kompleksin renginin spektrofotometrik yöntemlerle ölçümü sonucu ortamdaki aminoasit konsantrasyonu belirlenebilir.
Aminoasitleri ayıran çeşitli yöntemler
Kağıt kromatografisi
İnce tabaka kromatografisi
Yüksek performanslı likit kromatografi(HPLC)
İyon değiştirici kromatografi
Jel filtrasyon kromatografi
Yüksek voltajlı elektroforez

aminoasitler, doğal aminoasitler sentetik amino asitler,aminoasitlerin titrasyonu deneyi sonuç raporu hazırlık raporu biyokimya 1 laboratuvarı sivas cumhuriyet üniversitesi biyokimya aminoasitler biyokimya vize soruları












0 yorum:
Yorum Gönder